Liesegangsche Ringe - Eine Extraseite sind sie wert!
Die Kapazität der Seite "Zur Entstehung von Achaten" ist beschränkt, so dass dort nur wenige Bilder zum Phänomen der Liesegangschen Ringe eingebaut werden können. Hier ist Platz dafür:
Relativ viele Ackerflächen in und um Pforzheim liegen im Mittleren Muschelkalk, der reichlich Hornsteine liefert. Darunter sind welche, die die hellblaugraue Chalcedonfarbe haben und die Liesegangschen Ringe zeigen, bis hin zu einem "achatischen" Erscheinungsbild.
-----------------------------------------------------
Liesegangsche Ringe - beschreiben, erklären, definieren
Die Liesegangschen Ringe oder Liesegang-Ringe entstehen bei einer chemischen Reaktion in einem Gel. Zwei Substanzen reagieren miteinander.
Die eine Substanz ist schon im Gel gelöst. Die andere Substanz kommt dazu. Sie wird aufs Gel getröpfelt und dringt ins Gel ein. Das Eindringen ist kein schnelles Hineinfließen oder Einsickern, sondern ein langsames Diffundieren. Die Diffusion ist ein Phänomen für sich.
Im Gel reagieren die beiden Substanzen mitein-ander. Das Ergebnis der Reaktion, die neue Sub-stanz, wird im Gel sichtbar, wenn sie ausfällt, wenn sie sich am Gelboden niederschlägt. Das passiert nun nicht gleichmäßig, sondern perio-disch. Es entsteht keine gleichmäßige Nieder-schlagsfläche, sondern Niederschlagszonen in der Form konzentrischer Ringe.
Der deutsche Chemiker Raphael Eduard Liesegang hat die Ringbildung bei chemischen Reaktionen in einem Gel nicht als Erster entdeckt, sondern als Erster 1896 umfassend beschrieben. Die Ringe wurden dann mit seinem Namen verbunden: Liesegangsche Ringe sind periodisch entstehende Strukturen bei chemischen Reaktionen in einem Gel.
-----------------------------------------------------
Liesegangsche Ringe - experimentieren
Gelantine wird in erwärmtes, nicht kochendes Wasser eingerührt. Kaliumchromat kommt dazu.
Das Kaliumchromat löst sich in der Gelantine auf. Von der noch warmen Lösung wird so viel in eine Versuchsschale gegossen, dass der Boden gera-deso bedeckt ist, das heißt zwischen hauchdünn und 1 mm Höhe. Danach muss das Gel auskühlen, was ein paar Stunden dauern kann. (Die Lösung geliert nicht, wenn die Gelatine vorher in kochendes Wasser eingerührt wurde!)
Das zunächst noch sehr flüssige Gel erstarrt zu einer festen Schicht. Fest bedeutet weich, aber nicht mehr fließfähig. Jetzt kommt auf das kalium-chromathaltige Gel ein Tropfen Silbernitrat. Man tropft möglichst in der Mitte, damit sich die Ringe gleichmäßig ausbilden können. Am nächsten Tag und am übernächsten gibt es jeweils noch einen weiteren Tropfen Silbernitrat aufs Gel, um für die Ringbildung Substanz nachzuliefern.
Das Silbernitrat diffundiert ins Gel. Es kommt zu einer Reaktion zwischen Kaliumchromat (K2CrO4) und Silbernitrat (AgNO3). Es entsteht rotbraunes Silberchromat (Ag2CrO4), das die Fällungsringe bildet. Silberchromat ist eine feste, schwer lösliche Substanz.
Die abgebildete Versuchsschale wurde am Ende des Experiments gut verschlossen, weil die Substanzen nicht gesundsheitsfördernd sind.
-----------------------------------------------------
Liesegangsche Ringe - mikroskopieren
Die Liesegangschen Ringe auf dem durchsichtigen Schalenboden im obigen Experiment werden im Folgenden unter dem Mikroskop angesehen.
-----------------------------------------------------
Liesegangsche Ringe - Ackersteine der Pforzheimer Umgebung
In der Umgebung von Pforzheim liegen viele Äcker im Mittleren Muschelkalk. Die oberen Schichten des Mittleren Muschelkalks sind häufig stark verquarzt, und damit eben die Ackersteine. Zu diesen kieselsäurereichen Steinen und Gesteinen gehören der Hornstein, der Hornstein mit Quarzkristallen, der Chalcedon, der gebänderte Chalcedon, der Pforzheimer Stinkquarz, der Tripel und verquarzte Dolomitsteine.
-----------------------------------------------------
Liesegangsche Ringe - weitere Beispiele
-----------------------------------------------------
Liesegangsche Ringe - im Reagenzglas entstehen lassen
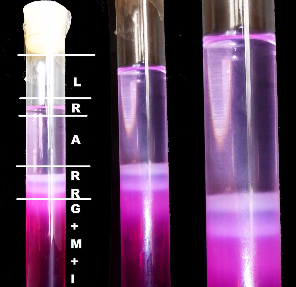
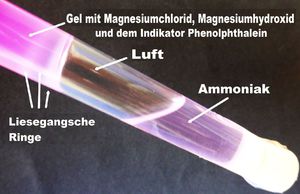
1. Gelantinepulver wird in warmes Wasser einge-rührt und aufgelöst. Hinzu kommen Magnesium-chlorid und ein Sichtbarmacher namens Phenolphthalein, der aber in der klaren Lösung unsichtbar bleibt. Die Lösung wird in ein Rea-genzglas gegeben, kühlt ab und geliert/ erstarrt zu einem Gel. In dem Gel sind nun zwei Sub-stanzen, Magnesiumchlorid und der Sichtbar-macher, beide nicht sichtbar.
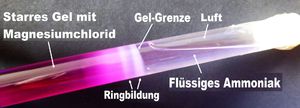
2. Auf das erstarrte Gel im Reagenzglas wird eine Ammoniaklösung geschüttet, etwa zwei Daumen hoch. Der Rest bis zum Verschluss gehört der Luft. Über dem festen Gel schwappt nun das flüssige Ammoniak.
3. Jetzt gilt es geduldig abzuwarten. Das Ammoniak diffundiert ins Gel und reagiert mit dem Magnesiumchlorid. Dabei entsteht Magnesiumhydroxid, das ausfällt, sich absetzt und Ringe bildet.
4. Das Gel ist bei Versuchsbeginn weder sauer noch alkalisch, eben pH-neutral. Das ins Gel diffundierende Ammoniak macht es zunehmend alkalisch. Das wiederum weckt den Sichtbar-macher, das Phenolphthalein. Der Indikator reagiert mit einer Farbveränderung von farblos zu pinkfarben. Farblos - pH-Wert neutral bei 7, pink - pH-Wert über 8 im alkalischen Bereich. Mit der Farbveränderung werden die Liesegangschen Ringe im Gel und im Gegenlicht sichtbar. Sie sind weniger pinkfarben, eher weiß, weil im Ring das ausgefällte Magnesiumhydroxid den pH-Wert wieder nach neutral hin verändert.